|
УДК 550.4.02+550.461
А.А. Авакян
г. Красноярск
 О ПРИРОДНОМ ГЕНЕЗИСЕ И ИСКУССТВЕННОМ СИНТЕЗЕ ГЕЙЛЮССИТА О ПРИРОДНОМ ГЕНЕЗИСЕ И ИСКУССТВЕННОМ СИНТЕЗЕ ГЕЙЛЮССИТА 
Исследовано взаимодействие микродисперсного кальцита, других солей Ca2+ и Ca(OH)2 с водными растворами Na2CO3×10H2O при комнатных условиях, приводящее к образованию гейлюссита Na2Ca(CO3)2×5H2O. Предложены методики синтеза этого минерала. На основании результатов экспериментов уточнена информация о его генезисе.
Илл. 1, библ. 4.
Ключевые словà: гейлюссит, методики синтеза, натрон, геохимия содовых озёр, двойные карбонаты
 Гейлюссит был открыт в 1826 году Ж.Б. Буссенго в озере Уро (Венесуэла); назван в честь французского учёного Ж.Л. Гей–Люссака. Информация об исследованиях этого минерала подытожена в [1]. Синтез гейлюссита реакцией Na2CO3 с CaCl2 в водном растворе описан в [2]: в мензурке, содержащей 100мл H2O, 18г Na2CO3, 10г CaCl2 и 800ppm полифосфата натрия сперва образовывались «главным образом сферолиты, предположительно CaCO3×H2O или фатерит»; при стоянии они растворялись, и формировались кристаллы Na2Ca(CO3)2×5H2O. Авторы [1] повторили синтез из [2] (см. выше), однако немедленно отфильтровали выпавший осадок и идентифицировали, что он является смесью гейлюссита и кальцита. Они предложили синтезировать гейлюссит из смеси NaHCO3÷Ca(OH)2÷H2O с соотношением компонентов 2÷1÷3, выдерживая её 10 дней при +60°C. Синтез гейлюссита из Na2CO3, CaCO3 и H2O описан в [3; стр. 779]: эквимолярная смесь Na2CO3 и CaCO3 измельчалась; затем четырежды нагревалась, охлаждалась и перемешивалась; затем к ней добавляли небольшое количество H2O и оставляли для автоупаривания, при котором получались кристаллы Na2Ca(CO3)2×5H2O. Гейлюссит был открыт в 1826 году Ж.Б. Буссенго в озере Уро (Венесуэла); назван в честь французского учёного Ж.Л. Гей–Люссака. Информация об исследованиях этого минерала подытожена в [1]. Синтез гейлюссита реакцией Na2CO3 с CaCl2 в водном растворе описан в [2]: в мензурке, содержащей 100мл H2O, 18г Na2CO3, 10г CaCl2 и 800ppm полифосфата натрия сперва образовывались «главным образом сферолиты, предположительно CaCO3×H2O или фатерит»; при стоянии они растворялись, и формировались кристаллы Na2Ca(CO3)2×5H2O. Авторы [1] повторили синтез из [2] (см. выше), однако немедленно отфильтровали выпавший осадок и идентифицировали, что он является смесью гейлюссита и кальцита. Они предложили синтезировать гейлюссит из смеси NaHCO3÷Ca(OH)2÷H2O с соотношением компонентов 2÷1÷3, выдерживая её 10 дней при +60°C. Синтез гейлюссита из Na2CO3, CaCO3 и H2O описан в [3; стр. 779]: эквимолярная смесь Na2CO3 и CaCO3 измельчалась; затем четырежды нагревалась, охлаждалась и перемешивалась; затем к ней добавляли небольшое количество H2O и оставляли для автоупаривания, при котором получались кристаллы Na2Ca(CO3)2×5H2O.
Новые результаты и их обсуждение
В результате исследований взаимодействия солей Ca2+ и Na2CO3×10H2O в водных растворах при комнатных условиях констатировано, что продуктом этой реакции оказывается CaCO3 когда 1) концентрация Na2CO3×10H2O достаточно низкая, либо 2) когда соль Ca2+ взята в избытке по отношению к Na2CO3×10H2O, что проводит к уничтожению гейлюссита по реакции:
Ca2+ + Na2Ca(CO3)2×5H2O → 2CaCO3 + 2Na+ + 5H2O.
В иных условиях может образовываться гейлюссит, причём в случае избытка Na2CO3×10H2O гейлюссит может оказаться единственным твёрдым продуктом этой реакции.
Приливание насыщенных водных растворов солей Ca2+, имеющих высокую растворимость (CaCl2×6H2O, Ca(NO3)2×4H2O), к насыщенному водному раствору Na2CO3×10H2O приводит к образованию тонкого гибкого кристаллического «чехла» вокруг капель раствора сòли Ca2+, поэтому для проведения этой реакции необходимо непрерывное очень сильное встряхивание. Если не разрушать этот «чехол» перемешиванием, то по разные его стòроны формируются условия для синтеза разных минералов: гейлюссита и кальцита.
Разные сòли Ca2+ имеют различные водорастворимость, гидрофильность, пространственные затруднения и содержание Ca2+. Эти факторы влияют на результат взаимодействия с Na2CO3×10H2O аналогично скорости перемешивания и соотношению реагентов. Поэтому в условиях, в которых возникает вышеописанный «чехол», разные сòли Ca2+ дают результат, различающийся количеством примеси CaCO3, размерами и формой кристаллов гейлюссита. Оптимальный результат получается при использовании нитрата кальция. Возможно использование его насыщенного раствора, кристаллов тетрагидрата, но лучше — порошка безводного Ca(NO3)2.
Для получения гейлюссита в насыщенный водный раствор Na2CO3×10H2O помещается порошок Ca(NO3)2 в объёмном соотношении раствор÷порошок ≥ 1÷40, после чего сразу же производится очень интенсивное встряхивание реакционного сосуда в течение 5 минут. Результатом оказывается чистый гейлюссит, выпадающий из раствора в виде бесцветных блестящих игольчатых кристаллов размером до 0,14мм:
Ca(NO3)2 + 2Na2CO3×10H2O → Na2Ca(CO3)2×5H2O↓ + 2NaNO3 + 5H2O.
Иглы гейлюссита, полученные этим способом из насыщенного водного раствора таурата кальция (β–аминоэтансульфонат), показаны на правом нижнем кадре иллюстрации.
В чистой H2O гейлюссит разлагается не мгновенно: при 0°C микрокристаллический кальцит появляется ≈ на восьмой минуте. Таким образом, если промывать гейлюссит водой, имеющей температуру 0°C, не дольше двух минут и затем сразу же промыть его избытком безводного ацетона (что сразу удалит воду), то можно получить практически чистый минерал.
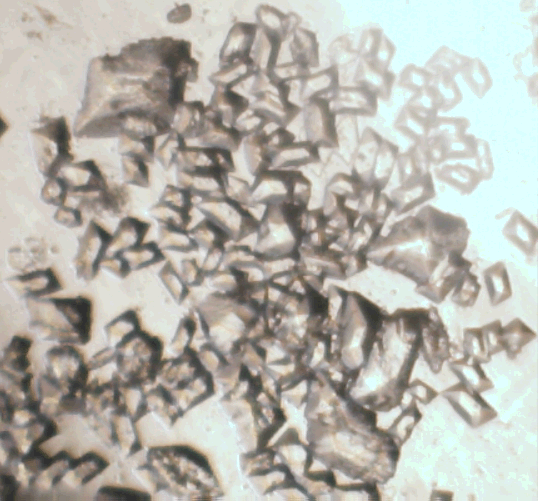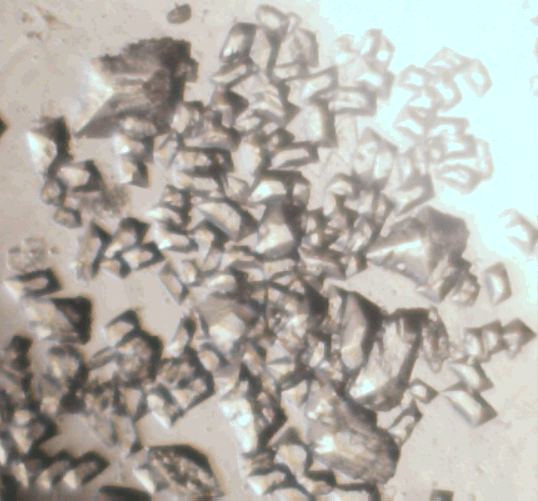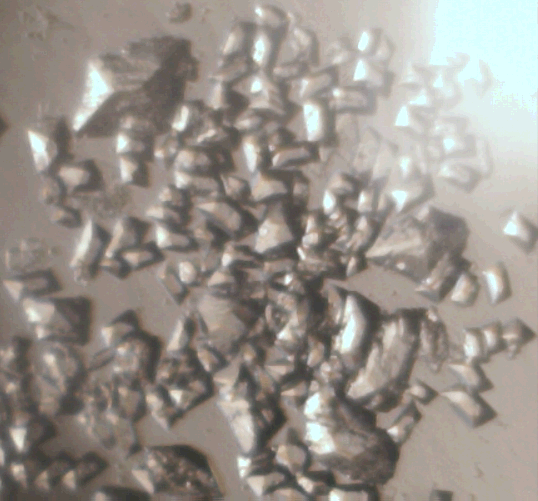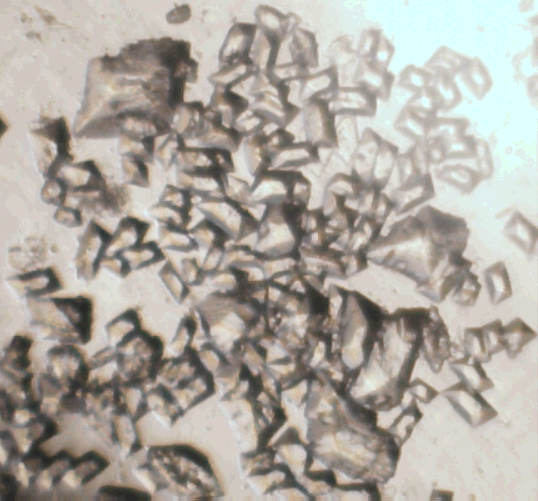
Морфологические типы гейлюссита, полученные различными способами. Пояснения в тексте
Иглы гейлюссита, полученные вышеописанным способом (но из насыщенного раствора Ca(NO3)2×4H2O при объёмном соотношении растворов Ca(NO3)2×4H2O÷Na2CO3×10H2O = 1÷40), были отданы на проведение рентгенофазового анализа заведующему лабораторией рентгеновских и спектральных методов анализа к.т.н. Жижаеву А.М. в институт химии и химической технологии СО РАН; прибор «ДРОН–3», аналитик Бондаренко Г.Н.. Их заключение: «Образец представлен моноклинным гейлюсситом (Na2Ca(CO3)2×5H2O, d=6,41; 3,21; 2,64 Å, JCPDS, 20–1088) и следовыми количествами натрита (Na2CO3, d=3,42; 2,96; 2,54 Å, JCPDS, 37–451), нахколита (NaНCO3, d=2,97; 2,60; 2,265 Å, JCPDS, 21–1119) и кальцита (CaCO3, d=3,89; 3,04; 2,28 Å, JCPDS, 7–1743)».
Выделить полученные иглы из раствора можно и без промывания: отфильтровав осадок через бумажный фильтр и не дожидаясь его высыхания, нужно выложить его между двумя сухими листами впитывающей бумаги; сдавить, надавливая на листы снаружи, и повторить такое отжимание несколько раз между новыми (сухими) участками бумаги. Полученный этим способом гейлюссит был отдан на рентгенофазововый анализ вышеназванным учёным (я выражаю им благодарность); их заключение: «Образец представлен моноклинным гейлюсситом (Na2Ca(CO3)2×5H2O, d=6,41; 3,21; 2,64 Å, JCPDS, 20–1088) и следовыми количествами нитратина (NaNO3, d=3,04; 2,31; 2,12 Å, JCPDS, 36–1474) и кальцита (CaCO3, d=3,85; 3,04; 2,28 Å, JCPDS, 47–1743)».
Если насыщенный водный раствор Na2CO3×10H2O разбавить водой 1÷1 по объёму, тщательно перемешать и к 14мл полученного раствора добавить 2 капли насыщенного водного раствора Ca(NO3)2×4H2O, после чего сразу же применить очень интенсивное встряхивание реакционного сосуда в течение 5 минут и затем оставить раствор на 12 часов для завершения реакции, — то результатом оказывается практически чистый гейлюссит в виде качественных идиоморфных (не игольчатых) кристаллов размером ≈0,05мм (они показаны на левом нижнем кадре иллюстрации). Если в этой методике заменить раствор Ca(NO3)2×4H2O на насыщенный водный раствор CaCl2×6H2O, то результатом оказываются более мелкие кристаллы гейлюссита и значительное количество микродисперсного кальцита, который, однако, за последующие 12 часов полностью растворяется: реагирует с Na2CO3×10H2O, образуя идиоморфные кристаллы гейлюссита (чтобы кальцит полностью прореагировал, я рекомендую полностью взмучивать осадок интенсивным перемешиванием раз в 2 часа).
Если в вышеприведенных методиках заменить Na2CO3×10H2O на NaHCO3, то образования гейлюссита не происходит, а образуются только продукты разложения Ca(HCO3)2 — кальцит, CO2 и H2O.
Реакцию микрокристаллического кальцита с насыщенным водным раствором Na2CO3×10H2O можно провести и с «заранее приготовленным» кальцитом. Кальцит с размером кристаллов ≈0,01мм синтезируется, например, продуванием CO2 через известковую воду. Слой полученного этим способом кальцита толщиной не более 0,2мм (иначе растущие кристаллы гейлюссита срастаются в корку, блокирующую доступ раствора к находящемуся ниже кальциту) помещается на дне раствора Na2CO3×10H2O, взятого в большом избытке. По этой методике вырастают хорошо огранённые идиоморфные кристаллики гейлюссита (они показаны на верхнем кадре иллюстрации), однако реакция идёт медленно (неделями):
Na2CO3×10H2O + CaCO3 → Na2Ca(CO3)2×5H2O + 5H2O.
Следует учитывать, что водные растворы Na2CO3×10H2O поглощают CO2 из воздуха; поэтому вышеприведенный синтез следует осуществлять в герметично закрытых ёмкостях.
Разбавленные водные растворы солей Ca2+ (в частности, растворы его малорастворимых солей) реагируют с насыщенным водным раствором Na2CO3×10H2O с образованием гейлюссита, если раствор Na2CO3×10H2O взят в достаточном избытке. При использовании сильно разбавленных растворов солей Ca2+ вышеописанный «чехол» практически не образуется, что нивелирует различия между разными солями Ca2+ в этой реакции.
Показательным примером является реакция насыщенных водных растворов Na2CO3×10H2O и CaSO4×2H2O (гипсовой воды): если прилить гипсовую воду к избытку насыщенного раствора Na2CO3×10H2O (в настоящей работе использовано объёмное соотношение, соответственно, 1÷8) и тщательно перемешать результирующий раствор, то он некоторое время остаётся почти прозрачным, и за несколько часов в нём возникает взвесь блестящих игольчатых столбчатых кристалликов гейлюссита, которые осаждаются на дно.
Замена гипсовой воды на известковую воду (насыщенный раствор Ca(OH)2), либо на насыщенный водный раствор Ca(HCO3)2 (он был получен пропусканием избытка CO2 через известковую воду с последующим тщательным фильтрованием) в тех же условиях даёт такой же результат (игольчатые кристаллы гейлюссита). Это доказывает, что присутствие в растворе OH− и HCO3− не мешает образованию гейлюссита.
Природные крепкие водные растворы Na2CO3×10H2O взаимодействовуют с твёрдыми, либо растворёнными в воде солями Ca2+. CaSO4×2H2O, Ca(HCO3)2, другие сòли Ca2+ и Ca(OH)2 сносятся водой (в виде растворов и твёрдых частиц) в содовые озёра, где встречаются с крепкими растворами Na2CO3×10H2O. Микрокристаллический кальцит весьма распространён в земной корè, легко образуется в гидросфере и биосфере и нередко контактирует с крепкими водными растворами Na2CO3×10H2O. Эти процессы были смоделированы в настоящем исследовании; это позволило уточнить условия, при которых синтезируется гейлюссит. Генезис природного гейлюссита не исчерпывается вышеописанными реакциями; например, в [1] описан процесс гидратации ниеререита в гейлюссит, однако исследования этого выходят за рамки данной работы.
При нагревании гейлюссит дегидратируется, образуя безводный Na2Ca(CO3)2 [1], [3; стр. 783], расплав которого может быть использован для выращивания искусственных алмазов (в качестве растворителя углерода) [4]. Предложенные в настоящей работе простые методики быстрого синтеза чистого качественного гейлюссита делают этот минерал доступным, что увеличивает доступность подобных перспективных технологий.
Автор выражает благодарность заведующему лабораторией рентгеновских и спектральных методов анализа института химии и химической технологии СО РАН к.т.н. Жижаеву А.М. и аналитику Бондаренко Г.Н. за выполнение рентгенофазовового анализа.
Библиографический список
1. Dheilly R.M., Tudo J. Contribution à létude de la gaylussite: Na2Ca(CO3)2×5H2O. Comptes Rendus de l'Académie des Sciences. Series IIB – Mechanics-Physics–Chemistry–Astronomy, 1997.
2. Dickens B., Brown W.E. The crystal structures of gaylussite, Na2Ca(CO3)2×5H2O and pirssonite, Na2Ca(CO3)2×2H2O. National bureau of standards report. June 30, 1968. Р. 2.
3. Johnson D.R., W.A. Robb. Gaylussite: thermal properties by simultaneous thermal analysis. American Mineralogist, Volume 58, 1973.
4. Солопова Н.А. Исследование роста кристаллов алмаза в карбонатных растворителях углерода. Москва: МГУ, 2008. С. 12.
 ABOUT THE GENESIS AND SYNTHESIS OF THE GAYLUSSITE ABOUT THE GENESIS AND SYNTHESIS OF THE GAYLUSSITE 
A.A. Avakyan
solanin@yandex.ru
The gaylussite Na2Ca(CO3)2×5H2O was synthesized from the microcrystalline calcite, other calcium salts and Ca(OH)2 + the water solutions of Na2CO3×10H2O at room temperature. The methods of synthesis of the gaylussite was elaborated. The results of the experiments explained the genesis of this mineral.
Keywords: gaylussite, methods of synthesis, natron, geochemistry of soda lakes, double carbonates
――――――――――――――
© Авакян А.А., 2018
| Эта статья с незначительными изменениями была опубликована в сборнике конференции «Научные чтения памяти П.Н. Чирвинского. Проблемы минералогии, петрографии и металлогении.». Выпуск 21; Пермь 2018; стр. 99–104. |
| Кристаллы гейлюссита, выросшие за неделю после растворения нескольких гранул промышленной кальциевой селитры в насыщенном водном растворе Na2CO3×10H2O: растворение происходило при интенсивном перемешивании, результатом чего стал микродисперсный кальцит, который за последующую неделю (ужè без перемешивания) полностью превратился в этот гейлюссит. |
|

![]() О ПРИРОДНОМ ГЕНЕЗИСЕ И ИСКУССТВЕННОМ СИНТЕЗЕ ГЕЙЛЮССИТА
О ПРИРОДНОМ ГЕНЕЗИСЕ И ИСКУССТВЕННОМ СИНТЕЗЕ ГЕЙЛЮССИТА ![]()
 Гейлюссит был открыт в 1826 году Ж.Б. Буссенго в озере Уро (Венесуэла); назван в честь французского учёного Ж.Л. Гей–Люссака. Информация об исследованиях этого минерала подытожена в [1]. Синтез гейлюссита реакцией Na2CO3 с CaCl2 в водном растворе описан в [2]: в мензурке, содержащей 100мл H2O, 18г Na2CO3, 10г CaCl2 и 800ppm полифосфата натрия сперва образовывались «главным образом сферолиты, предположительно CaCO3×H2O или фатерит»; при стоянии они растворялись, и формировались кристаллы Na2Ca(CO3)2×5H2O. Авторы [1] повторили синтез из [2] (см. выше), однако немедленно отфильтровали выпавший осадок и идентифицировали, что он является смесью гейлюссита и кальцита. Они предложили синтезировать гейлюссит из смеси NaHCO3÷Ca(OH)2÷H2O с соотношением компонентов 2÷1÷3, выдерживая её 10 дней при +60°C. Синтез гейлюссита из Na2CO3, CaCO3 и H2O описан в [3; стр. 779]: эквимолярная смесь Na2CO3 и CaCO3 измельчалась; затем четырежды нагревалась, охлаждалась и перемешивалась; затем к ней добавляли небольшое количество H2O и оставляли для автоупаривания, при котором получались кристаллы Na2Ca(CO3)2×5H2O.
Гейлюссит был открыт в 1826 году Ж.Б. Буссенго в озере Уро (Венесуэла); назван в честь французского учёного Ж.Л. Гей–Люссака. Информация об исследованиях этого минерала подытожена в [1]. Синтез гейлюссита реакцией Na2CO3 с CaCl2 в водном растворе описан в [2]: в мензурке, содержащей 100мл H2O, 18г Na2CO3, 10г CaCl2 и 800ppm полифосфата натрия сперва образовывались «главным образом сферолиты, предположительно CaCO3×H2O или фатерит»; при стоянии они растворялись, и формировались кристаллы Na2Ca(CO3)2×5H2O. Авторы [1] повторили синтез из [2] (см. выше), однако немедленно отфильтровали выпавший осадок и идентифицировали, что он является смесью гейлюссита и кальцита. Они предложили синтезировать гейлюссит из смеси NaHCO3÷Ca(OH)2÷H2O с соотношением компонентов 2÷1÷3, выдерживая её 10 дней при +60°C. Синтез гейлюссита из Na2CO3, CaCO3 и H2O описан в [3; стр. 779]: эквимолярная смесь Na2CO3 и CaCO3 измельчалась; затем четырежды нагревалась, охлаждалась и перемешивалась; затем к ней добавляли небольшое количество H2O и оставляли для автоупаривания, при котором получались кристаллы Na2Ca(CO3)2×5H2O.
![]() ABOUT THE GENESIS AND SYNTHESIS OF THE GAYLUSSITE
ABOUT THE GENESIS AND SYNTHESIS OF THE GAYLUSSITE ![]()